Instituto Politécnico Nacional

Escuela Nacional de Medicina y Homeopatía
CUESTIONARIO DE LIPIDOS...
a) ácidos grasos poliinsaturados. Ácido graso que contiene más de un doble enlace.
b) Micela. Estructuras esféricas relativamente pequeñas en las que intervienen desde docenas hasta millares de moléculas ordenadas de modo que sus regiones hidrofobicas se agregan en el interior y los grupos de cabeza hidrofilitos esta en la superficie de contacto del agua.
c) Bicapa lipídica. Agregado lipidico en la que se combinan en dos monocapas lipídicas formando una hoja bidimensional. Se da cuando las áreas transversales del grupo de la cabeza y las cadenas laterales son similares.
d) inositol. Vitamina B8, se necesita para la formación correcta de las membranas celulares.
e) Gangliósidos. Son los esfingolipidos mas complejos, contienen dos cabezas polares muy grandes formadas por varias unidades glucídicas. Constituyen el 6% de los lipidos de la materia gris.
f) Enfermedad de tay-sachs. Acumulación de un gangliósido especifico en el cerebro y en el bazo debido a la falta de enzima lisosómica hexosaminidasa A, enzima degradante que hidroliza normalmente un residuo de N-acetil-D-galactosamina y uno de D-galactosa en la cabeza polar del gangliosido. Como resultado se acumula el gangliósido parcialmente degradado produciendo degeneración del sistema nervioso. Síntomas: retraso progresivo del crecimiento, parálisis, ceguera y muerte a los 3 o 4 años de edad.
g) Aterosclerosis. Acumulación patologica de colesterol en los vasos sanguineos con el resultado de obstrucción de los vasos sanguíneos. Esta ligada a niveles elvados de colesterol en sangre ligado a la LDL.
k) acido graso omega-3,
l) Jabones. Glicerol y sales Na o K de los acidos grasos, obtenidos por el calentamiento de grasas animales con NaOH o KOH, poseen la capacidad de solubilizar o dispersar materiales insolubles en agua mediante la formación micelas.
m) triacilglicerol. Lipidos mas sencillos obtenidos a partir de acidos grasos, llamados triglicéridos, grasas o grasas neutras.
n) grasas saturadas. Son aquellos que presentan enlaces simples en la cadena hidrocarbonada, se dispone en el espacio en zig-zag.
o) prostaglandinas. Contienen un anillo de 5 átomos de carbono que originalmente formaba parte de la cadena de ácido araquidónico.
p)Ácidos grasos trans. Tipo de grasa que se encuentra principalmente en alimentos industrializados que han sido sometidos
2) ¿cuál de las moléculas siguientes están en la familia de compuestos lípidos?
1-decanolalaninafructosaÁcido palmiticoXtrimiristinGlicerolXAdeninab-caroteneAspartameInsulinaubiquininaEtanolEstimasterol
3) Resuelva la nomenclatura de taquigrafía para cada uno de los ácidos siguientes grasos.
a) 17:2 D 9, 121, 14,171 ,8
b) 21:4 D
4) Resuelva la nomenclatura de taquigrafía para cada uno de los ácidos siguientes grasos.
a) 10:1 D 4 CH3CH2CH2CH=CH(CH2)5COOHb) 18:2 D 9, 12 CH3(CH2)5CH=CHCH2CH=CH(CH)5COOHc) 18:3 D 9, 12,15 CH3(CH2)5CH=CHCH2CH=CHCH2CH=CHCH2CH2COOH5)
Algunos científicos y médicos ahora recomiendan a la ingestión de aceite de pescado por reducir el riesgo de problema cardíaco. Los dos componentes de ácidos principales grasos en una cápsula de aceite de pescado son debajo.
Dibuje las estructuras de estos compuestos.
Explique por qué los jabones en soluciones acuosas se reúnen en estructuras de micelas.
En la formación de una micela de jabón en agua, las moléculas de jabón (una sal de sodio o potasio de un ácido graso) se enlazan entre sí por sus extremos hidrófobos que corresponden a las cadenas hidrocarbonadas, mientras que sus extremos hidrófilos, aquellos que llevan los grupos carboxilo, ionizados negativamente por pérdida de un ion sodio o potasio, se repelen entre sí. De esta manera las cadenas no polares del jabón se ocultan al agua, mientras que los grupos carboxilo, cargados negativamente, se hallan expuestos a la misma.
8) ¿Cómo funcionan las sales biliares en la digestión de grasas?
Compuestos antipáticos sintetizados en el hígado a partir de colesterol, se almacenan en la vesícula biliar y se liberan al intestino delgado después de la ingestión de una comida que contenga grasas, actúan como detergentes biológicos, convirtiendo las grasas de la dieta en micelas mixtas de ácidos biliares y triacilgliceroles, la formación de micelas incrementa la fracción de moléculas de lípido accesibles a la acción de las lipasas hidrosolubles en el intestino, que convierte los triacligliceroles en monoacilgliceroles y diacligliceroles, ácidos grasos libres y glicerol. Estos productos de la acción de las lipasas se difunden hacia el interior de la mucosa intestinal, donde se convierte de nuevo a triacilgliceroles y se empaquetan junto con el colesterol de la dieta y proteínas específicas para formar agregados lipoproteícos denominados quilomicrones.
9) Escriba una reacción o describa la acción de cada enzima
.a) Lipasa. Las lipasas en el intestino colaboran en la digestión y absorción de las grasas de la dieta. Catalizan la hidrólisis enzimatica de los triacilgliceroles
.b) Prostaglandina sintetasa. Desencadenan la contracción de la musculatura lisa; fiebre; inflamación.
c) Lipoxigenasa.La acción de la 15-lipoxigenasa sobre el ácido araquidónico genera dos metabolitos terminales, la Lipoxina A (LXA) y Lipoxina B (LXB). Ambos metabolitos tienen acción inductora de la degranulación de los neutrófilos, siendo LXB dos órdenes de magnitud más potente que LXA. También se ha demostrado que inhiben la reacción citotóxica de los linfocitos T. Killer, sin afectar su unión a las células blanco.
10) ¿Por qué algunos aceites de cocina, canola y el aceite de oliva, se hacen rancios más pronto que mantequillas sólidas?
Porque la mantequilla sólida esta parcialmente hidrogenizada y resiste mas tiempo que los aceites
11) Los lípidos de la membrana, tienen una cola polar delantera y no polar.
Asigna estas dos regiones en cada una de las moléculas siguientes.
a) Colesterol. Cabeza polar (grupo hidroxilo) C-3
b) fosfatidilcolinac) esfingomielinad) cerebrósidose) b- sitosterol
12) ¿Cuales son moléculas importantes en el metabolismo de energía?
a) triacilgliceridos. Si
b) terpenos. No
c) glicerofosfolipidos. Si
d) cerebrósidos.
e) b- sitosterol12)
cuestiOnariO II parte

 GLICERALDEHIDO
GLICERALDEHIDO
El licor de Fehling consiste en dos soluciones acuosas:
Sulfato de cobre cristalizado, 35 g; agua destilada, hasta 1.000 ml.
Sal de Seignette(Tartrato mixto de Potasio y Sodio), 150 g; solución de hidróxido de sodio al 40%, 3; agua, hasta 1.000 ml.
Ambas se guardan separadas hasta el momento de su uso para evitar la precipitación del hidróxido de cobre (II).
El ensayo con el licor de Fehling se funda en el poder reductor del grupo carbonilo de un aldehído. Éste se oxida a ácido y reduce la sal de cobre (II) en medio alcalino a óxido de cobre (I), que forma un precipitado de color rojo. Un aspecto importante de esta reacción es que la forma aldehído puede detectarse fácilmente aunque exista en muy pequeña cantidad. Si un azúcar reduce el licor de Fehling a óxido de cobre (I) rojo, se dice que es un azúcar reductor.
Se utiliza como reactivo para la determinación de azúcares reductores, y es útil para demostrar la presencia de glucosa en la orina, y también para detectar derivados de la glucosa como la sacarosa o la fructosa..
Al reaccionar con monosacáridos, se torna verdoso; si lo hace con disacáridos, toma el color del ladrillo.

a) Glucosa.- Positiva


ALMIDON

Los almidones comerciales se obtienen de las semillas de cereales, particularmente de maíz (Zea mays), trigo (Triticum spp.), varios tipos de arroz (Oryza sativa), y de algunas raíces y tubérculos, particularmente de patata (Solanum tuberosum), batata (Ipomoea batatas) y mandioca (Manihot esculenta). Tanto los almidones como los almidones modificados tienen un número enorme de posibles aplicaciones en los alimentos, que incluyen las siguientes: adhesivo, ligante, enturbiante, formador de películas, estabilizante de espumas, agente anti-envejecimiento de pan, gelificante, glaseante, humectante, estabilizante, texturizante y espesante.
El almidón se diferencia de todos los demás carbohidratos en que, en la naturaleza se presenta como complejas partículas discretas (gránulos). Los gránulos de almidón son relativamente densos, insolubles y se hidratan muy mal en agua fría. Pueden ser dispersados en agua, dando lugar a la formación de suspensiones de baja viscosidad que pueden ser fácilmente mezcladas y bombeadas, incluso a concentraciones mayores del 35%.

El glucógeno representa la principal forma de almacenamiento de carbohidratos tanto en animales como en las plantas. Cuando existe una disminución significativa de glucosa en sangre, el glucógeno es degradado por medio de una serie de enzimas para cubrir las necesidades energéticas de nuestro organismo. Las glucogenosis son enfermedades en donde existen deficiencias congénitas de la mayoría de las enzimas relacionadas con el metabolismo del glucógeno, en donde los órganos más afectados son: el hígado y el músculo esquelético.
Los signos y síntomas clínicos más característicos son: hepatomegalia, hipoglucemia, osteoporosis, entre otros y en ocasiones son débiles y poco aparentes. Existen diversas pruebas de laboratorio para realizar un diagnóstico específico.

EPIMEROS: En química, un epímero es un estereoisómero de otro compuesto que tiene una configuración diferente en uno solo de sus centros estereogénicos.Cuando se incorpora un epímero a una estructura en anillo, es llamado anómero.Los epímeros ocurren con frecuencia en los carbohidratos, por ejemplo la D-glucosa y la D-manosa difieren en C2, el primer átomo de carbono quiral, por lo tanto son epímeros en C2.
ANÓMERO: Anómeros α y β de la D-glucopiranosa.Se define anómero como los isómeros de los monosacáridos de más de 5 átomos de carbono que han desarrollado una unión hemiacetálica, lo que les permitió tomar una estructura cíclica y determinar 2 diferentes posiciones para ellion oxhidrilo (α o β). Los ángulos de unión de los carbonos de los extremos de los monosacáridos de más de 5 carbonos permiten un enroscamiento de las moléculas lineales, en la que la función aldehído de las aldosas en el carbono 1 se ubica próxima al oxhidrilo del carbono 5 para formar una unión hemiacetálica (reacción de un aldehído o cetona con un alcohol), lo que provoca la ruptura del doble enlace de la primera función para unirse con el grupo oxhidrilo del carbono 5, dando como desecho H20. Lo mismo sucede con las cetosas, pero en este caso la unión hemiacetalica se dan entre el carbono 2 y el carbono 5. Es esta estrcutura cíclica de isomería la que determina que el glúcido sea α o β.
ENANTIÓMERO: En la ciencia de la química se dice que dos estereoisómeros son enantiómeros si la imagen especular de uno no puede ser superpuesta con la del otro. Dicho de otra forma: un enantiómero es una imagen especular no superponible de sí mismo. Tienen las mismas propiedades físicas y químicas, excepto por la interacción con el plano de la luz polarizada o con otras moléculas quirales. Son moléculas quirales. La mezcla de enantiómeros en una solución se denomina mezcla racémica.CaracterísticasLas moléculas que contienen un estereocentro son siempre quirales. Aunque esto no es cierto necesariamente para moléculas con más de un esterocentro. Este es el caso de las formas meso. Los enantiómeros tienen las mismas propiedades químicas y físicas, a excepción de su respuesta ante la luz polarizada (actividad óptica). Por ello se les denomina isómeros ópticos.Un enantiómero que rota el plano de la luz polarizada, al pasar a su través, en el sentido de las agujas del reloj, se dice que es dextrorrotatorio o dextrógiro. Si lo hace al contrario, es levorrotatorio o levógiro.Las moléculas aquirales son ópticamente inactivas.La rotación específica de la luz polarizada, que se mide por medio de un polarímetro, es una propiedad física característica de la estructura de cada enantiómero, de su concentración y del disolvente empleado en la medición.
a) Gliceraldehido - Dihidroxiacetona = Par aldosa-cetosa
b) Glucosa - Fructosa = Par aldosa-cetosa


c) D-glucosa - D-manosa = Epímeros
d) Triosa - Eritrosa = Epímeros
e) 2-glucosamina - 2-galactosamina = Epímeros
g) D-glucosa – L-glucosa = Epímeros

cuestiOnariO
Temas en clase, Monosacáridos.


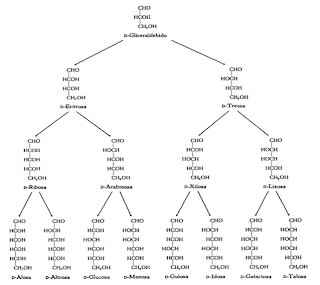
- 5 carbonos: pentosas, hay cuatro, según la posición del grupo carbonilo: D-ribosa, D-arabinosa, D-xilosa, D-lixosa.
- 6 carbonos: hexosas, hay ocho, según la posición del grupo carbonilo: D-alosa, D-altrosa, D-glucosa, D-manosa, D-gulosa, D-idosa, D-galactosa, D-talosa.
Las cetosas de 3 a 6 átomos de carbono son:
- Triosas: hay una: Dihidroxiacetona.
- Tetrosas: hay una: D-Eritrulosa.
- Pentosas: hay dos, según la posición del grupo carbonilo: D-Ribulosa, D-xilulosa.
- Hexosas: hay cuatro según la posición del grupo carbonilo: D-sicosa, D-fructosa, D-sorbosa, D-tagatosa.

Temas en clase, Disacáridos.
Los disacáridos o azúcares dobles son un tipo de hidratos de carbono, o carbohidratos, formados por la unión de dos monosacáridos iguales o distintos mediante enlace O-glucosídico, mono o dicarbonílico, que además puede ser α o β en función del -OH hemiacetal. Los disacáridos más comunes son:

La fórmula empírica de los disacáridos es C12H22O11. El enlace covalente entre dos monosacáridos provoca la eliminación de un átomo de hidrógeno de uno de los monosacáridos y de un grupo hidroxilo del otro monosacárido.
En la mucosa del tubo digestivo del hombre existen unas enzimas llamadas disacaridasas, que hidrolizan el enlace glucosídico que une a los dos m onosacáridos, para su absorción intestinal
onosacáridos, para su absorción intestinal
Temas en clase, Polisacáridos.
Compuestos de peso molucular muy elevado.
- Propiedades:
No son dulces.
Pueden ser solubles, formar suspensiones colidales o ser insolubles.Se pueden hidrolizar a monosacáridos
- Clasificación
Por los monosacáridos constituyentes:
Homopolisacáridos: mismo tipo de monosacárido repetido
Heteropolisacáridos: diferente tipo
Por la ramificación de la molécula
Lineales: Cada monosacárido dos enlaces glucosídicos a otros
Ramificados: Algún monosacárido con más de dos uniones a otros
- Por su función
Estructurales : Forman elementos estructurales de las células o los organismos pluricelulares
De reserva: Reserva de monosacáridos
De reconocimiento: Reconocimineto celular
Polisacáridos de reservas suelen ser ramificados y se encuentran en citoplasma o vacuolas. Polisacáridos estructurales suelen ser lineales
Los polisacáridos de reserva sirven para acumolar monosacáridos, generalmnete glucosa, sin aumnetar la presión osmótica celular. Suelen ser lineales para movilizar más rapidamente los restos de monosacárido

Temas en clase pH

Temas en clase Ecuación de Henderson-Hasselbalch
Considera la ionización de un ácido débil HA que tiene algún valor de pKa. Es conveniente poder relacionar el pH de una disolución de un ácido débil con su pKa y con el grado de ionización. La reacción sería:
HA H+ + A-
La constante de disociación del ácido (Ka) para esta reacción, vendría dada por la ecuación
Esta ecuación se puede reorganizar para despejar la concentración de iones hidrógeno porque, recuerda, queremos una ecuación que relacione el pH de la disolución con el pKa y con el grado de ionización del ácido débil. La forma en la que queda la ecuación es
Por definición, log ( 1/ [H+] ) = pH y log ( 1/Ka ) = pKa , así que, aplicando logaritmos a la ecuación anterior, obtenemos
- La aspirina es un ácido débil (le cuesta trabajo liberarse de los iones H) con un pka de 3.5. Se absorbe a la sangre a través delas células que cubren el estómago y el intestino delgado. La absorción requiere del paso a través de la membrana plasmática, la velocidad del cual viene determinada por la molaridad de la molécula: las moléculas cargadas y muy polares pasan lentamente, mientras que las que son hidrófobas neutras pasan rápidamente . El pH del contenido del estómago es de larededor de 1.5 y el pH del intestino delgado es de 6 ¿Dónde se absorbe más aspirina en el estómago o en el intestino delgado?
Se absorbe más aspirina en el estómago ya que sus moléculas están menos cargadas y por lo tanto pasan mas rápidamente.
pka= 3.5
pH estómago= 1.5
pH intestino= 6
Estómago:
pH= 3.5+log [A-]/[1molar]
1.5-3.5=log [A-]
10-2= [A-]
[A-]= 0.1
Intestino delgado:
pH= 3.5 + log [A-]/[1 molar]
6-3.5= log [A-]
2.5=log [A-]
102.5=[A-]
[A-]= 316.22 (pasan las moléculas más lentas porque están más cargadas y más polares)
- Tratamiento de la urticaria por hiedra venenosa. Los componentes de la hiedra y el roble venenosos que proucen la urticaria carcterística, son catecoles sustituidos con grupos alquilos de cadena larga. Si el lector hubiera estado expuesto a la acción de la hiedra venenosa ¿Cuál de los tratamientos siguientes aplicaría a el área infectada? pka=8
- (a) Lavar el área con agua fría. pH 7
- (b) Lavar el área con vinagre diluido o de zumo de limón. pH 3
- (c) Lavar el área con jabón y agua. pH 8
- (d) Lavar el área con jabón, agua y bicarbonato de sódico. pH 13
Sustituyendo en la fórmula de la ecuación de Henderson-Hasselbalch
(a) pH-pka=log [A-]/[HA]
7(1molar)= 8 +log[A-]
7-8=log[A-]
-1=log[A-]
10-1= 0.1 Agua fría.
(b) pH-pka= log [A-]/[HA]
3(1 molar) = 8+ log [A-]
3-8=log [A-]
-5=log [A-]
10-5 =[A-]
[A-]= 1x10-5 Vinagre diluido o de zumo de limón.
(c) pH-pka=log [A-]/[HA]
8(1 molar)= 8 + log [A-]
8-8=log [A-]
0=log [A-]
100 =[A-]
[A-]= 1 Jabón y agua.
(d) pH-pka=log [A-]/[HA]
13(1 molar)= 8 + log [A-]
13-8=log [A-]
5= log [A-]
105= [A-]
[A-]=100000 jabón, agua y bicarbonato sódico.
Las moléculas de la solución de jabón, agua y bicarbonato sódico son las más cargadas y polares en comparación con las demás soluciones y por lo tanto al lavar el área infectada por veneno con jabón, agua y bicarbonato sódico el veneno pasará más lentamente al organismo. Mientras tanto, las moléculas de la solución de vinagre diluido o zumo de limón son mucho menos polares e hidrófobas neutras en dicha solución pasaría más rápidamente el veneno. En este problemas conviene que el veneno pase lo más lentamente posible y por ello el área infectada debe de ser lavada con jabón, agua y bicarbonato sódico.
Temas en clase Carbohidratos

Tipos de Carbohidratos
Monosacáridos. son los que están formados por una molécula de azúcar
Disacáridos. Al hidrolizarse producen dos monosacáridos.(2 moléculas de azúcar)
Oligosacáridos. Al hidrolizarse se producen de tres a veinte moléculas de monosacáridos.
Polisacáridos. Al hidrolizarse producen más de veinte moléculas de monosacáridos.(miles de moléculas de azúcar)
Temas en clase Ácidos y bases.

- Según Arrhenius un ácido es una especie química que en solución acuosa es capaz de liberar un ión H. Y una base es la que libera un ión OH.
- Según Bronsted-Lewry un ácido es una sustancia capaz de liberar un protón. Y una base es una sustancia cpaz de aceptar un protón.
- Lewis dice que una base es aquella sustancia química capaz de donar un par de electrón y un ácido acepta un par de electrón.

Unidad 1
 El agua es un compuesto formada por dos átomos de hidrógeno y uno de oxígeno. Su fórmula molecular es H2O. Se halla en forma líquida en los mares, ríos, lagos y océanos. En forma sólida, nieve o hielo, en los casquetes polares, en las cumbres de las montañas y en los lugares de la Tierra donde la temperatura es inferior a cero grados Celsius. Y en forma gaseosa se halla formando parte de la atmósfera terrestre como vapor de agua.
El agua es un compuesto formada por dos átomos de hidrógeno y uno de oxígeno. Su fórmula molecular es H2O. Se halla en forma líquida en los mares, ríos, lagos y océanos. En forma sólida, nieve o hielo, en los casquetes polares, en las cumbres de las montañas y en los lugares de la Tierra donde la temperatura es inferior a cero grados Celsius. Y en forma gaseosa se halla formando parte de la atmósfera terrestre como vapor de agua.  El agua es el componente celular más abundante y tiene el caracter de componente indispensable para la vida, así los los nutrientes que consume la célula, el oxígeno que emplea para oxidarlos y sus productos de desecho son transporatdos por el agua y la mayoría de las funciones de los organismos como nutrición, excresión, respiración dependen de la oresencia del agua.
El agua es el componente celular más abundante y tiene el caracter de componente indispensable para la vida, así los los nutrientes que consume la célula, el oxígeno que emplea para oxidarlos y sus productos de desecho son transporatdos por el agua y la mayoría de las funciones de los organismos como nutrición, excresión, respiración dependen de la oresencia del agua. - Es un buen disolvente, así son tomados los nutrientes por las células y son eliminados los desechos.
- Posee un calor específico elevado, contribuyendo a mantener constante la temperatura de los organismo, propiedad que impide el calentamiento y el enfriamiento rápido de los seres vivos.
- Sirve como lubricante del cuerpo, ejemplo; el mucus de las fosas nasales.
Propiedades físicas:
- Presenta un punto de ebullición de 373 K (100 °C) a presión de 1 atm.
- Tiene un punto de fusión de 273 K (0 °C) a presión de 1 atm.
- El agua pura no conduce la electricidad (agua pura quiere decir agua destilada libre de sales y minerales)
- Es un líquido inodoro e insípido. Estas son las propiedades organolépticas, es decir, las que se perciben con los órganos de los sentidos del ser humano.
- Se presenta en la naturaleza de tres formas, que son: sólido, líquido o gas.
- Tiene una densidad máxima de 1 g/cm3 a 277 K y presión 1 atm. Esto quiere decir que por cada centímetro cúbico (cm3) hay 1g de agua.
- Forma dos diferentes tipos de meniscos: cóncavo y convexo.
- Tiene una tensión superficial, cuando la superficie de los líquidos se comporta como una película capaz de alargarse y al mismo tiempo ofrecer cierta resistencia al intentar romperla y esta propiedad ayuda a que algunas cosas muy ligeras floten en la superficie del agua.
- Posee capilaridad, que es la propiedad de ascenso o descenso de un líquido dentro de un tubo capilar.
- La capacidad calorífica es mayor que la de otros líquidos.
- El calor latente de fusión del hielo se define como la cantidad de calor que necesita un gramo de hielo para pasar del estado sólido al líquido, manteniendo la temperatura constante en el punto de fusión (273 k).
- Calor latente de fusión del hielo a 0 °C: 80 cal/g (ó 335 J/g)
- Calor latente de evaporación del agua a 100 °C: 540 cal/g (ó 2260 J/g)

Enlace iónico.
 enlace iónico al enlace químico de dos o más átomos cuando éstos tienen una diferencia de electronegatividad de 1.7 ó mayor.. Este tipo de enlace fue propuesto por W. Kossel en 1916. En una unión de dos átomos por enlace iónico, un electrón abandona el átomo menos electronegativo y pasa a formar parte de la nube electrónica del más electronegativo
enlace iónico al enlace químico de dos o más átomos cuando éstos tienen una diferencia de electronegatividad de 1.7 ó mayor.. Este tipo de enlace fue propuesto por W. Kossel en 1916. En una unión de dos átomos por enlace iónico, un electrón abandona el átomo menos electronegativo y pasa a formar parte de la nube electrónica del más electronegativoEnlace covalente.
En este enlace cada uno de los átomos aporta un electrón. Los orbitales de las capas de valencia de ambos átomos se combinan para formar uno solo que contiene a los 2 electrones.
El enlace covalente se representa con una linea recta que une a los 2 átomos, por ejemplo:
Características del enlace covalente:
- Es muy fuerte y se rompe con dificultad.
- Si la diferencia de electronegatividades entre los 2 átomos es marcada, tenemos un enlace polar y se favorecerá la solubilidad de la substancia en solventes polares. Ejemplo: un enlace O-H
- Si la diferencia de electronegatividades es poca, tenemos un enlace no polar y se favorecerá la solubilidad de la substancia en solventes no polares. Ejemplo: un enlace C-H o C-C
Experimento 4

Experimento 3
2.- Partir en rodajas una papa y colocarlas en la solución.
3.- Dejar reposar 30 minutos y reportar.
Resultados:
Rodajas de papa en solución de agua con NaCl.
En una solución obtenida de agua con sal, se procedió a introducir a dicha solución rodajas de una papa, la cual al paso del tiempo se observó que alrededor de ellas se desprendió como una especie de polvo. Uno de los aspectos importantes del experimento es que usualmente cuando una papa es partida al cabo de un tiempo comienza a ponerse negra, lo que hizo la solución de agua con NaCl fue conservar la papa, es decir la papa no se puso negra seguía en el mismo estado que se encontraba cuando recién se habían hecho las rodajas.
Otra característica muy importante en la papa fue que en ella ocurrió un fénomeno llamado plasmólisisque es la contracción del citoplasma de una célula consecuencia de la pérdida de agua por acción osmótica y en este caso se dio por la sobresaturación de sal en donde la papa se deshidrató y adoptó un forma endeble al transcurrir el tiempo.


Células de la papa antes de la plasmólisis ....y después.
Experimento 2
2.- Mezclar esta solución con agua muy lentamente y observar.

Resultados:
El fenómeno ocurrido en este experimento puede justificarse con una de las pripiedades del agua, la cual es su densidad, ya que la densidad del agua con sal es mayor que la densidad del agua simple. La densidad es una magnitud referida a la cantidad de masa contenida en un determinado volumen, y puede utilizarse en términos absolutos o relativos.

Experimento 1
1.- Llenar un plato con agua, agregarle pimienta cubriendo toda la superficie.
2.- A un cotonete se le remoja con jabón líquido y sumergirlo en el plato.
3.- Observar el fenómeno.
Resultados:
Al colocar la pimienta en el agua, entra en contacto y se expande en toda la superficie del plato, posteriormente al introducir el cotonete con jabón líquido, en la solución, la pimienta inmediatamente se abre hacia alrededor del cotonete por toda la periferia de éste.
El fenómeno que ocurre en este experimento posiblemente se debe a la Ley de la Electrostática, la cual que estudia los fenómenos eléctricos producidos por distribuciones de cargas estáticas, esto es, el campo electrostático de un cuerpo cargado, el experimento afirma lo que enuncia la Ley, caragas iguales se repeelen (+)(+) y (-)(-) y cargas diferentes se atraen (+)(-) en el experimento existen cargas iguales y es por ello que no se atrae la pimienta con el cotonete con jabón.

"Cargas iguales se repelen, caragas diferentes se atraen"

